ЕГЭ по химии — отработка задания №5
Задания для самопроверки
- Задания для самопроверки являются обязательным условием для усвоения материала, к каждому разделу прилагаются тестовые задания по пройденной тематике, которые необходимо решить.
- Решив все задания из раздела, вы увидите свой результат и сможете посмотреть ответы ко всем примерам, что поможет понять какие ошибки вы совершили, и где ваши знания необходимо укрепить!
- Тест представляет собой 10 тестов задания 5, части 1 ЕГЭ, ответы перемешиваются случайным образом, и берутся из созданной нами базы вопросов!
- Постарайтесь получить выше 90% верных ответов, чтобы быть уверенными в своих знаниях!
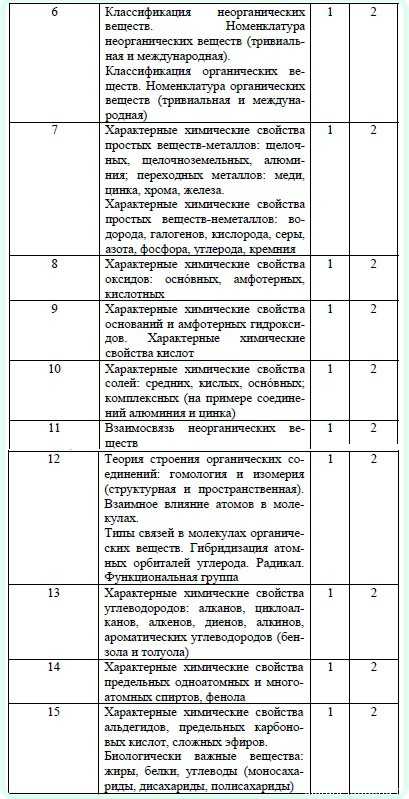
-
Если вы занимаетесь с репетитором, то пишите в начале тестирования свое реальное имя! Полагаясь на ваше имя, репетитор найдет пройденное вами тестирование, просмотрит ваши ошибки и учтет ваши пробелы чтобы в дальнейшем их заполнить!
- Пользуйтесь только справочным материалом представленным ниже, если вы хотите проверить закрепление материала!
- После прохождения теста посмотрите ответы к вопросам где вы ошиблись и закрепите материал перед повторным прохождением!
10 тестов по пятому заданию в ЕГЭ по химии.
Рекомендуем также посмотреть разбор заданий №5 в ЕГЭ по химии!
Справочный материал для прохождения тестирования:
Таблица Менделеева Таблица растворимостиТипы вопросов которые встречаются в данном тесте (ответы на вопросы и полные условия заданий вы можете посмотреть пройдя тест выше до конца. Как решать данные вопросы мы советуем смотреть в нашем курсе химии):
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции слева, подберите соответствующую позицию справа.
www.chem-mind.com
Трудные задания ЕГЭ по химии
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
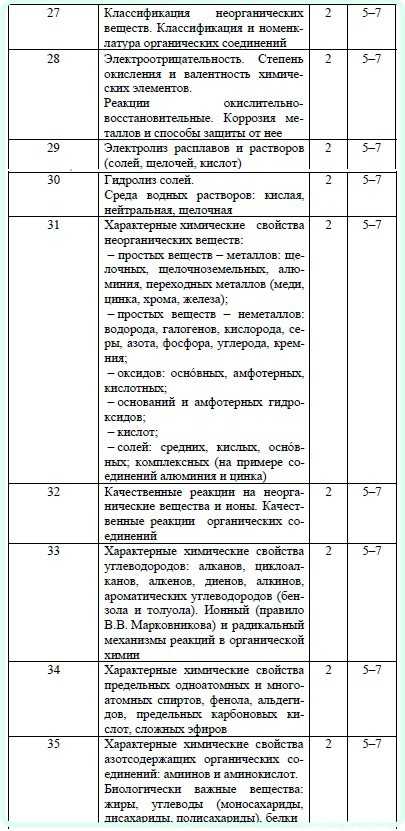
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
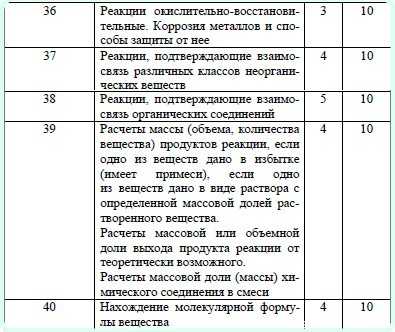
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
получение фосфора:
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
2С10Н22 + 31O2 = 20CО2 + 22H2О
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
maratakm.narod.ru
Задания ЕГЭ по Химии | Дистанционные уроки
06-Июл-2012 | комментариев 7 | Лолита Окольнова
Принципиальных изменений в ЕГЭ 2015 нет
1. Уменьшено число заданий базового уровня сложности с 28 до 26 заданий.
2. Максимальный балл за выполнение всех заданий экзаменационной работы 2015 года составляет 64 (вместо 65 баллов в 2014 году).
3. Изменена система оценивания задания на нахождение молекулярной формулы вещества. Максимальный балл за его выполнение – 4 (вместо 3 баллов в 2014 году).
Чтобы знать, какие темы нужно пройти, существует такой документ — план ЕГЭ. В нем детально расписаны не только темы, но и максимальный балл, и время, которое стоит потратить на выполнение каждого задания.
По ходу подготовки к экзамену, когда для тренировки прорешивают все варианты ЕГЭ, стоит засекать время — над некоторыми заданиями имеет смысл посидеть подольше, некоторые должны решаться быстро.
К каждому варианту экзаменационной работы прилагаются следующие материалы:
− Периодическая система химических элементов Д.И. Менделеева (черно-белая) ;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор.
Спецификация заданий ЕГЭ по химии :
Часть А:
максимум можно набрать 26 баллов
Первая часть теста включает 26 заданий. К каждому из них даны четыре варианта ответа, из которых нужно выбрать один правильный.

Часть В:
максимально можно набрать 18 баллов
Вторая часть теста состоит из 10 заданий. Ответ надо дать в виде числа или последовательности цифр.
Часть С:
Реакции и задачки
максимум — 20 баллов
- С1 — ОВР — можно решать обычным, привычным большинству методом, можно методом полуреакций, главное, чтобы было правильно составлено уравнение и расставлены правильные коэффициенты. Правильно определены окислитель и восстановитель;
- С2 — написать уравнения реакций по описанию химического эксперимента;
- С3 — органическая цепочка
- С4 — задачи по неорганике
- С5 — задачка (органика)
Всего заданий – 40;
Максимальный первичный балл за работу – 64.
Общее время выполнения работы – 180 мин.
Для тренировки — демо-варианты ЕГЭ с 2011 по 2015 гг:
Подробный разбор всех тем и примеры заданий можно найти на странице ХИМИЯ
Есть примеры ЕГЭ — типовые задания
(платные материалы — для доступа необходим пароль)
КАК ПОЛУЧИТЬ ПАРОЛЬ?
Категории: |
Обсуждение: «Задания ЕГЭ по Химии»
(Правила комментирования)distant-lessons.ru
ЕГЭ по химии — отработка задания №26
Задания для самопроверки
- Задания для самопроверки являются обязательным условием для усвоения материала, к каждому разделу прилагаются тестовые задания по пройденной тематике, которые необходимо решить.
- Решив все задания из раздела, вы увидите свой результат и сможете посмотреть ответы ко всем примерам, что поможет понять какие ошибки вы совершили, и где ваши знания необходимо укрепить!
- Тест представляет собой 10 тестов задания 26, части 1 ЕГЭ, ответы перемешиваются случайным образом, и берутся из созданной нами базы вопросов!
- Постарайтесь получить выше 90% верных ответов, чтобы быть уверенными в своих знаниях!
-
Если вы занимаетесь с репетитором, то пишите в начале тестирования свое реальное имя! Полагаясь на ваше имя, репетитор найдет пройденное вами тестирование, просмотрит ваши ошибки и учтет ваши пробелы чтобы в дальнейшем их заполнить!
- Пользуйтесь только справочным материалом представленным ниже, если вы хотите проверить закрепление материала!
- После прохождения теста посмотрите ответы к вопросам где вы ошиблись и закрепите материал перед повторным прохождением!
10 тестов по заданию 26 в ЕГЭ по химии.
Справочный материал для прохождения тестирования:
Таблица Менделеева Таблица растворимостиТипы вопросов которые встречаются в данном тесте (ответы на вопросы и полные условия заданий вы можете посмотреть пройдя тест выше до конца. Как решать данные вопросы мы советуем смотреть в нашем курсе химии):
- Установите соответствие между названием лабораторного оборудования и его применением: к каждой позиции слева, подберите соответствующую позицию справа.
- Установите соответствие между названием высокомолекулярного вещества и формулой соответствующего ему мономера: к каждой позиции слева, подберите соответствующую позицию справа.
- Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате: к каждой позиции слева, подберите соответствующую позицию справа.
- Установите соответствие между используемым в быту веществом и областью его применения: к каждой позиции слева, подберите соответствующую позицию справа.
- Установите соответствие между органическим веществом и его природным источником или способом промышленного получения: к каждой позиции слева, подберите соответствующую позицию справа.
- Установите соответствие между природным источником углеводородов и продуктом, полученным в результате его переработки: к каждой позиции слева, подберите соответствующую позицию справа.
www.chem-mind.com

